医药生物:仿制药供给侧改革使竞争格局有望巨变
1.事件
近日,CFDA发布“关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》的有关事项(征求意见稿)”。
2.我们的分析与判断
(一)范围广、力度大、进度快,一致性评价目录预计还有后文
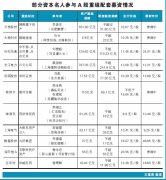
范围广:征求意见稿中提及“化学药品新注册分类实施前批准上市的仿制药,包括国产仿制药、进口仿制药和原研药品地产化品种,均须开展一致性评价。”定义范围涉及品种非常广,直指全部仿制药。此次公布的品种目录清单,包括292个带剂型品种(444个规格),涉及17000余文号,近2000家药企(包括内资、外资),近80家上市公司(详细见我们整理附件),从另一个角度印证了此次一致性评价涉及范围之广。鉴于此目录清单中引入了部分非基药品种,并且还有一些基药品种规格尚未纳入,不排除后续一致性评价目录再度扩容的可能性。
力度大:虽然按照政策原文,此次品种目录应该是2007年10月1日前批准上市的列入国家基本药物目录(2012年版)中的化学药品仿制药口服固体制剂品种,但是通过我们的梳理,我们发现目录里面存在13个非基药品种(盐酸地尔硫卓片、齐多夫定胶囊、奈韦拉平片、齐多夫定片、司他夫定胶囊、复方炔诺酮片、复方左炔诺孕酮片、醋酸甲地孕酮片、复方醋酸甲地孕酮片、复方磷酸萘酚喹片、炔雌醇片、拉米夫定片、依非韦伦片),2个非基药规格(品种是基药,但规格不是),非基药在目录里面的提及,说明推进力度之大,已经渗透少数非基药,另外,我们还发现一些特殊剂型的占比不小(做一致性难度很高),其中肠溶片剂及肠溶胶囊包括11个品种,缓释胶囊及缓释片剂包括18个品种,口腔崩解片1个,我们认为非基药、非基药规格以及缓控释剂型的列入体现了一致性评价推进力度之大,前所未有。
进度快:此次CFDA发布“关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》的有关事项(征求意见稿)”距离3月初国务院办公厅印发《关于开展仿制药质量和疗效一致性评价的意见》,相距不到一个月的时间,配套的有关事项便落地征求意见,在进度上是大超预期的(相比以往政策推进速度)。另外,征求意见稿明确给出了两个时限,也体现了一致性评价推进速度之快,一个是2018年底完成(2007年10月1日之前上市并列入2012基药目录的+特别标注的非基药品种,给了目录),二是非上述品种,第一家一致性评价完成之后,三年如果还做不完,就不再受理,此批文就有消失的风险。
(二)仿制药供给侧改革致使行业竞争格局有望巨变,“实力型”仿制药企有望受益,“国际化”仿制药企明确受益
上文已经讨论过,由于此次一致性评价推进速度快,任务量大,时间紧,292个目录品种(具体涉及约17000个文号)需在2018年底完成一致性评价,据草根调研显示,一般严格意义上做一次BE需要费用大约在400-500万,但是有能力做、并且做好的配套机构供给量并不是非常充裕,预计BE费用在未来几年仍有望继续增加,相对于很多品种的年销售额(参见我们统计的表格),这项支出绝对是奢侈的,只有“实力型”仿制药企业才可能承担起这些相对高昂的费用,我们估计,在这些品种中未来将会有大量的品种会因为一致性评价的推行而在市场上消失,从另一个角度,对于2007年之前获批的许多品种,即使有资金支持做BE,其真正的实验结果也不同乐观,所以企业自身也不会花大量资金去挑战这种低性价比的“不确定性”。随着一致性评价的推进,仿制药行业绝大多数品种竞争格局将得到净化,并有望巨变,良币驱劣币,“实力型”仿制药企(经济实力保障一致性评价推进,仿制研发实力决定其品种的正规“靠谱性”)有望大幅受益,具体标的可关注恒瑞医药、华东医药、信立泰、恩华药业等传统制药龙头白马。
在征求意见稿中提及,“在中国境内用同一条生产线生产上市并在欧盟、美国和日本获准上市的药品,由受理和举报中心负责申报资料受理;一致性评价办公室通知药审中心对原境内、外上市申报资料进行审核;通知食核查中心负责对生产现场进行检查。经审核后视同通过一致性评价。”此项规定配套前文“自第一家通过一致性评价后,三年后不再受理其他药品生产企业的同品种一致性评价申请。”的规定,这对于一些企业来讲是巨大利好,比如像京新药业,一致性评价大大简化。而对于一些企业来讲,绝对是致命的,三年的时间去做BE,必须马上动起来,若做不成,文号就彻底消失了,留下的时间不多了;另外,征求意见稿中,还提及“国内药品生产企业已在欧盟、美国和日本获准上市的仿制药,按照《关于发布化学药品注册分类改革工作方案的公告》(2016年第51号)的有关要求申报仿制药注册申请,由药审中心审评,批准上市后视为通过一致性评价。”配套以《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》中提及的说法“国内药品生产企业已在欧盟、美国和日本获准上市的仿制药,可以国外注册申报的相关资料为基础,按照化学药品新注册分类申报药品上市,批准上市后视同通过一致性评价;在中国境内用同一生产线生产上市并在欧盟、美国和日本获准上市的药品,视同通过一致性评价。”对于“国际化”的企业是重大利好,只要其有品种在海外销售,其通过一致性评价的时间有望大大加快,比如华海药业。总体说来,我们认为,此次征求意见稿对于国际化企业是确定性利好受益。
(三)整体趋严,但仍留有口子,征求意见稿中个别要点仍值得后续重点关注
我们认为仿制药一致性评价推进整体趋严,但是在部分地方仍留有了口子,值得后续重点关注:关于原化学药品注册分类下的非6类药:征求意见稿中提及“化学药品新注册分类实施前批准上市的仿制药,包括国产仿制药、进口仿制药和原研药品地产化品种,均须开展一致性评价。”这里有一个灰色地带就是原化学药品注册分类下的非6类药,尤其是原3类药,其不属于这里面的范畴,但是其本质上就是仿制药,仿制药一致性评价如何推进?还有就是改酸根、改碱基、改剂型、该规格等原分类下面的品种,要不要做?如何推进?个人觉得不会就这样不了了之,后续值得重点关注。
关于无参比制剂品种:征求意见稿中提及“企业找不到且无法确定参比制剂的,由药品生产企业开展临床有效性试验。”这其实是对之前大家争论不休的问题的统一答复,没有参比制剂怎么办?要做临床有效性实验,这总算是对于一些品种给了解决方案,但是临床有效性实验比一致性评价实验执行难度并不小。
关于生物等效豁免:征求意见稿中提及“对符合《人体生物等效性豁免指导原则》的品种,由药品生产企业申报,一致性评价办公室组织审核后公布,允许药品生产企业采取体外溶出试验的方法进行一致性评价。”这是一个不确定性,豁免品种如果只做体外的话,工作量将大大减少,大幅受益,但是如何限定?如何推进?值得后续重点关注。
总体来看,我们认为,此次CFDA发布“关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》的有关事项(征求意见稿)”,时间上超预期,并且进度快、力度大,范围广,我们估计一致性评价目录后续还有后文,随着仿制药一致性评价的跪进,行业竞争格局将得到净化,“实力型”仿制药企有望受益,“国际化”仿制药企明确受益,具体可关注标的华海药业、京新药业、恒瑞医药、华东医药、信立泰、恩华药业等等。
3.风险提示
政策落地不达预期。(中国银河证券)
下一篇:商业贸易:叠加内在管理改善预期
更多"医药生物:仿制药供给侧改革使竞争格局有望巨变"...的相关新闻
每日财股

- 每日财股:保 千 里(600074)
投资亮点 1.2015年12月份,公司拟(出资1.96亿元,占19.6%))与深圳市深国融前海金融...[详细]