重磅消息!新冠疫苗真来了 获批军队内部使用
新冠疫苗真的来了?
康希诺生物:重组新冠疫苗获军队特需药品批件
限军队内使用
6月29日早间,康希诺生物股份公司(康希诺生物-B(港股06185),06185.HK)公告披露,重组新型冠状病毒疫苗(腺病毒载体)获得军队特需药品批件。
公告称,公司与军事科学院军事医学研究院生物工程研究所联合开发的重组新型冠状病毒疫苗(腺病毒载体)(Ad5-nCoV),已于2020年6月25日获得中央军委后勤保障部卫生局(下称“军委后保部”)颁发的军队特需药品批件,有效期一年。
Ad5-nCoV的I期及II期临床试验已在中国开展,并于2020年6月11日完成II期临床试验。康希诺生物称,临床试验数据证实其具有良好的安全性,及较高的体液免疫及细胞免疫应答水平。总体试验结果表明,Ad5-nCoV具有预防由SARS-CoV-2引起的疾病的潜力。
公告提到,根据《中国人民解放军实施〈中华人民共和国药品管理法〉办法》有关规定,Ad5-nCoV现阶段仅限军队内部使用,未经军委后保部批准,不得扩大接种范围。
康希诺生物同时提醒:我们无法保证我们将能最终成功商业化Ad5-nCoV。

不过,这一重大利好的新闻,却并未对康希诺生物的股价带来多大的提升作用。
今日开盘,康希诺生物股价涨幅一度达到7.98%,随后开始下跌,日内股价一度下跌1.82%。
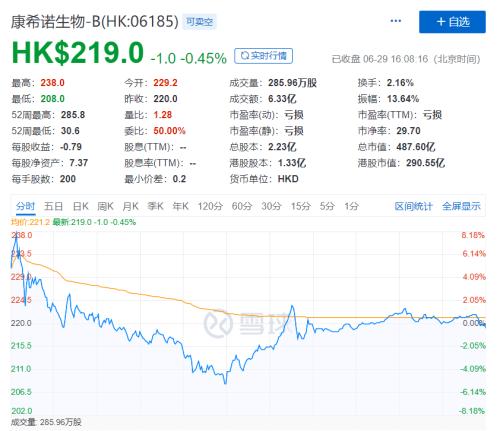
康希诺生物股价的弱势表现,或与其此前公告已充分释放预期有关。
自今年3月4日起,该公司就不断公告其在新冠病毒疫苗研发方面的进展。伴随着其研发进展的不断更新,公司股价同样一路爬升,前期价格的上涨或已包含了公司疫苗研发落地的表现。
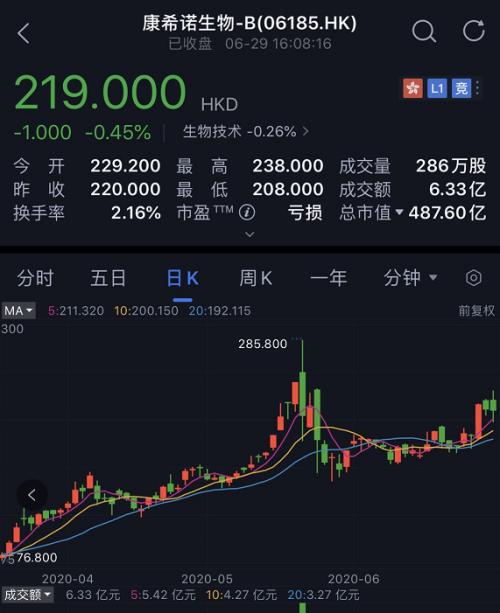
另一方面,目前该疫苗仅能在军队内部使用,公司无法保证其最终能够商业化,成为抑制股价上涨的另一因素。
这款疫苗如何研发?
这款Ad5-nCoV疫苗由康希诺生物和军事科学院军事医学研究院生物工程研究所陈薇院士团队联合开发。该疫苗是一种表达SARS-CoV-2 刺突糖蛋白(S蛋白)的复制缺陷Ad5载体疫苗。疫苗使用一种减毒的普通感冒病毒(腺病毒,易感染人类细胞,但不致病)将编码SARS-CoV-2 刺突(S)蛋白的遗传物质传递给细胞。随后这些细胞会产生S蛋白,并到达淋巴结,免疫系统产生抗体,识别S蛋白并击退冠状病毒。
此前的5月22日晚间,顶级医学期刊《柳叶刀》(The Lancet)刊发一篇论文,题为“重组腺病毒5型载体COVID-19疫苗的安全性,耐受性和免疫原性:剂量递增,开放标签,非随机,首次人类试验”。陈薇等研究人员报告了在中国健康成年人中使用的Ad5载体COVID-19疫苗在接种后28天内的1期临床数据,初步评估疫苗的安全性、耐受性和免疫原性。
陈薇当时表示,“这些结果是一个重要的里程碑。试验表明,单次接种复制缺陷型人腺病毒5型(Ad5)载体新冠疫苗在14天内就能诱导产生病毒特异性抗体和T细胞应答,这使其成为具有潜力的可以进行下一步研究的候选疫苗。”
陈薇同时表示,“我们对这些结果应谨慎解读。研发COVID-19疫苗的挑战是前所未有的,诱导免疫应答的能力并不一定表明该疫苗能完全保护人类免受SARS-CoV-2的感染。这些结果为新冠疫苗研发提供了积极前景,但距离该疫苗上市,我们还有很多工作要做。”
康希诺生物于2009年注册于天津滨海新区,专业从事高质量人用疫苗的研发、生产和商业化,建立了针对13个疾病领域的16种创新疫苗产品的研发管线,涵盖了对新型冠状病毒肺炎、埃博拉病毒病、结核病、脑膜炎、百白破、带状疱疹等一系列疾病的预防。2019年3月,康希诺生物在香港联交所主板H股上市,成为内地首家赴港上市的未盈利疫苗公司。
2020年1月,公司正式递交科创板上市申请并获得受理,拟募集资金用于新型疫苗产能扩大与新疫苗产品研发。
4月30日,康希诺生物科创板IPO成功过会,成为“港股+科创板”疫苗概念第一股。
此前已有国企员工出国可接种新冠病毒疫苗
6月10日消息称,中国部分大型国有企业的员工在出国前,可以自愿选择注射目前正在研发的新冠病毒疫苗。
11日,《环球时报》报道称,向有海外业务项目的两家大型国企进行核实,相关工作人员证实了这一消息,并表示“听说部分有出国需要的央企人员已注射疫苗”。相关专家表示,建议出境人员接种正在研制的新冠病毒疫苗一方面说明有关部门对于这种灭活疫苗安全性很有把握;另一方面也可以被视作Ⅲ期临床试验的一部分,有科研意义。
知情人士透露,打算赴境外出差的中国国企员工可自愿选择接种由国药集团中国生物技术股份有限公司下属公司开发的疫苗,报道称“中国监管部门已向国有企业传达了这一提议”。
彭博社报道称,上述实验性疫苗目前处于II期临床阶段,正在进行人体安全性的检测。疫苗能否有效预防感染只有到III期才会明确,这也是获得市场推广审批之前的最后一关。在III期阶段,将有数千人注射疫苗,以评估疫苗在疫情活跃的环境中是否有效,由于中国国内每日新增病例数已十分稀少,疫苗将需要在疫情仍未消退的海外进行检验。
公开报道显示,疫苗临床研究一共分为3期,安全性贯穿整个临床阶段,其中Ⅲ期临床试验主要评估疫苗的有效性,需要在疾病流行的背景下,完成免疫原性评估需要6个月以上时间,完成保护力试验则需要更长的时间,因此完成Ⅲ期临床试验,最后得出疫苗安全、有效的结论,可能需要一年的时间。